Dystrophies rétiniennes héréditaires
Révision par le Dr Philippa Vincent, MRCGPDernière mise à jour par le Dr Colin Tidy, MRCGPDernière mise à jour le 21 juillet 2023
Répond aux besoins du patient lignes directrices éditoriales
- TéléchargerTélécharger
- Partager
- Langue
- Discussion
Professionnels de la santé
Les articles de référence professionnelle sont destinés aux professionnels de la santé. Ils sont rédigés par des médecins britanniques et s'appuient sur les résultats de la recherche et sur les lignes directrices britanniques et européennes. Vous trouverez peut-être l'article sur les problèmes visuels plus utile, ou l'un de nos autres articles sur la santé.
Dans cet article :
Poursuivre la lecture ci-dessous
Vue d'ensemble1
Les dystrophies rétiniennes héréditaires constituent un large groupe de troubles oculaires héréditaires entraînant une perte de vision irréversible. Elles se développent en raison de mutations dans un ou plusieurs gènes qui entraînent la mort des cellules photoréceptrices de la rétine. On sait que des mutations dans plus de 200 gènes sont associées à toutes les différentes formes de troubles rétiniens.
Les voies thérapeutiques étudiées pour ces troubles comprennent la thérapie génique pour remplacer le gène défectueux, le traitement par des facteurs neurotrophiques pour stimuler la croissance des photorécepteurs, la thérapie de remplacement cellulaire et les prothèses capables de capter la lumière et de transmettre des signaux électriques au cerveau par l'intermédiaire des neurones rétiniens. Une combinaison d'approches impliquant à la fois le remplacement du gène et le remplacement des cellules peut être nécessaire pour obtenir un bénéfice optimal.
La rétinite pigmentaire est la dystrophie rétinienne la plus fréquente, touchant 1 personne sur 3 000. La plupart des mutations de la rétinite pigmentaire affectent sélectivement les bâtonnets. Voir l'article séparé sur la rétinite pigmentaire.
Contrairement à la rétinite pigmentaire, dans laquelle la dégénérescence des bâtonnets affecte d'abord la rétine périphérique, de nombreuses dystrophies rétiniennes héréditaires touchent principalement la macula. Les dystrophies maculaires se caractérisent par une perte progressive de l'acuité visuelle, de la vision des couleurs et de la sensibilité aux contrastes, qui se manifeste généralement au cours de la deuxième décennie de la vie. Il existe une variété de noms (qui se chevauchent souvent).
Un diagnostic correct est important, car il détermine le pronostic attendu. Une thérapie génique spécifique pour un certain nombre de maladies est en cours d'évaluation.2
Anatomie de la rétine
La rétine est une structure à plusieurs couches et les dystrophies rétiniennes peuvent affecter n'importe laquelle d'entre elles. Du vitré à la choroïde, ces couches sont la membrane limitante interne, la couche de fibres nerveuses, la couche de cellules ganglionnaires, la couche plexiforme interne, la couche nucléaire interne, la couche plexiforme externe, la couche nucléaire externe, la membrane limitante externe, les segments interne et externe des bâtonnets et des cônes et l'épithélium pigmentaire rétinien (EPR).
The macula has a high density of cones, ganglion cells, and pigment within bipolar and ganglion cells. La zone centrale de 1,5 mm de la macula est la fovéa. À l'intérieur de la fovéa se trouve une zone avasculaire à peu près circulaire, la zone avasculaire fovéale, qui ne contient que des cônes.
Anatomie de la rétine
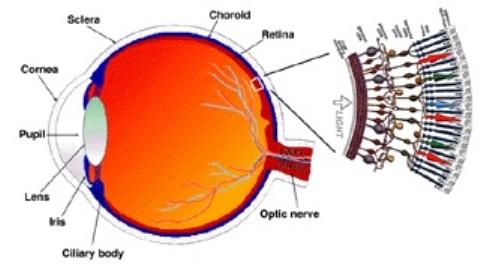
Via Wikimedia Commons
Poursuivre la lecture ci-dessous
Dystrophies rétiniennes héréditaires symptômes (présentation)2
Cela varie en fonction de la maladie. La rétine compte 60 à 125 millions de bâtonnets et 3,2 à 6,5 millions de cônes. Aucun bâtonnet n'est présent dans la fovéa, bien que la densité la plus élevée de bâtonnets se trouve à une distance d'environ 20° de la fovéa. Les cônes sont principalement concentrés dans la fovéa et sont plus denses à l'intérieur de la fovéola. Par conséquent, les maladies affectant les bâtonnets tendent à provoquer des problèmes visuels nocturnes ainsi que des défauts du champ visuel périphérique. Les maladies affectant les cônes entraînent une sensibilité accrue à la lumière, une perte de la vision centrale, une altération de la vision des couleurs et des défauts du champ visuel central.
Diagnostic2
Le diagnostic est généralement établi sur la base d'un examen clinique et de tests subjectifs, bien qu'il doive être confirmé par des tests électrodiagnostiques. Cela permet de différencier la maladie rétinienne de la maladie choroïdienne et de garantir la précision du diagnostic (ce qui est important compte tenu des implications génétiques).
La fundoscopie - également en lumière rouge - les tests du champ visuel, les tests électrophysiologiques et les électrorétinogrammes multifocaux (ERG), ainsi que les tests d'évaluation de la vision des couleurs peuvent tous contribuer au diagnostic.
Tests rétiniens subjectifs
Tests de vision des couleurs : les plus connus sont les plaques du test d'Ishihara, qui permettent de distinguer le daltonisme rouge du daltonisme vert. D'autres tests plus sophistiqués permettent d'évaluer le daltonisme jaune et de diagnostiquer des degrés complexes et subtils de daltonisme.
L'adaptométrie de l'obscurité est utile pour les patients qui se plaignent de cécité nocturne (nyctalopie), une caractéristique fréquente de ces troubles.
Évaluation objective de la rétine
L'angiographie à la fluorescéine peut aider à différencier la maladie rétinienne de la maladie choroïdienne.
Les ERG enregistrent le potentiel d'action produit par la rétine en réponse à la lumière et montrent des schémas typiques dans des conditions d'obscurité (scotopique) et de lumière (photopique). Les écarts par rapport aux ondes normales facilitent le diagnostic de la même manière qu'un ECG. Pendant le test, une électrode est placée sur la cornée pour mesurer les réponses électriques de la rétine à la lumière.
Les électro-oculogrammes (EOG) complètent les mesures ERG. Ils mesurent le potentiel permanent entre la cornée, électriquement positive, et le fond de l'œil, électriquement négatif. Un EOG anormal est le résultat de problèmes dans le RPG.
De nouvelles méthodes sont en cours d'évaluation, telles que la tomographie par cohérence optique dans le domaine spectral à haute résolution (SD-OCT) et l'autofluorescence du fond d'œil.
Tests génétiques2
Les tests génétiques conventionnels seraient coûteux et prendraient beaucoup de temps, étant donné que des mutations dans plus de 200 gènes sont impliquées dans la gamme variée des dystrophies. Les nouvelles méthodes de test génétique offrent la possibilité d'analyser plusieurs gènes. Elles permettent des analyses beaucoup plus rapides et plus rentables.
Poursuivre la lecture ci-dessous
Traitement et prise en charge des dystrophies rétiniennes héréditaires 2 3
La prise en charge est axée sur le diagnostic et le conseil génétique spécialisé. Les options thérapeutiques sont limitées et tendent à se concentrer sur la rééducation visuelle optométrique (par exemple, utilisation d'aides à la basse vision, formation à l'orientation et à la mobilité). Des travaux sont également en cours dans le domaine de la thérapie moléculaire et génique, les gènes responsables étant de mieux en mieux identifiés.
La disponibilité et la fourniture des services multidisciplinaires hautement spécialisés dont les patients ont besoin varient d'un bout à l'autre du Royaume-Uni.
La recherche dans le domaine de la thérapie génique est prometteuse. Par exemple, dans l'amaurose congénitale de Leber, qui est associée à un dysfonctionnement et à une dégénérescence des photorécepteurs, des études ont montré certains effets positifs de la thérapie génique.
Exemples de maladies rétiniennes héréditaires4
Il existe une variété de dystrophies rétiniennes héréditaires, dont certaines sont très rares. Elles se caractérisent par une perte d'acuité visuelle. Ces affections sont une cause majeure de déficience visuelle grave et touchent des patients de tous âges. Elles varient au niveau génétique, ainsi qu'aux niveaux clinique, histologique et physiopathologique. Les recherches génétiques en cours continuent de faire évoluer la compréhension de la physiopathologie.
Maladie de Stargardt et fundus flavimaculatus2
On s'est demandé s'il s'agissait de deux maladies ou d'une seule. La maladie de Stargardt ou fundus flavimaculatus est une forme progressive de dégénérescence maculaire juvénile présentant une hétérogénéité clinique et génétique. Des mutations dans au moins quatre gènes sont responsables de caractéristiques cliniques similaires et il n'existe pas de distinction diagnostique claire entre ces deux maladies. La maladie de Stargardt et le fundus flavimaculatus sont traités ici comme une seule et même entité.
La maladie de Stargardt, avec ou sans fundus flavimaculatus, est la dystrophie héréditaire la plus fréquente affectant la rétine centrale. Elle touche 1 personne sur 8 000 à 10 000.5
Description - également connue sous le nom de dystrophie maculaire juvénile : il s'agit de l'une des deux formes les plus courantes de dégénérescence maculaire héréditaire. Elle représente 7 % de toutes les dystrophies rétiniennes. Décrite pour la première fois par l'ophtalmologiste allemand Karl Stargardt en 1909, il s'agit d'une dystrophie maculaire atrophique progressive et bilatérale caractérisée par des "taches gris-jaune sales" périmaculaires et périphériques (fundus flavimaculatus).
Héritage - principalement autosomique récessif ; il existe une rare variante autosomique dominante.
Présentation - de l'enfance (environ 6 ans) au début de l'âge adulte : diminution bilatérale (généralement) de la vision centrale. Elle est souvent disproportionnée par rapport au tableau clinique. On observe également un daltonisme progressif.
Pronostic - généralement mauvais. La plupart des patients connaissent une détérioration rapide de leur vision au cours des deux premières décennies de leur vie. Une fois que la vision tombe en dessous de 6/12, la progression est rapide et le pronostic visuel est mauvais. La rééducation visuelle permet d'atteindre et de maintenir un certain degré d'indépendance.6
Une variante appelée fundus flavimaculatus se présente plus tard et la macula peut être épargnée. Le patient peut présenter une détérioration visuelle centrale. La détérioration de la vision des couleurs peut n'être remarquée que plus tard. La répartition et le nombre de taches jaunâtres peuvent changer au fil du temps. Le pronostic est généralement meilleur et la vision périphérique et nocturne n'est pas affectée.
Maladie de Best juvénile (dystrophie maculaire vitelliforme de Best)2
La maladie de Best a été identifiée par Friedrich Best en 1906 et est la deuxième dystrophie héréditaire de la macula la plus fréquente.
Description - elle se caractérise par une accumulation anormale de lipofuscine au niveau du RPG. Celle-ci s'accroît au fil des ans pour finir par donner un aspect caractéristique de jaune d'œuf rond, qui peut être associé ultérieurement à un pseudo-hypopion.
Hérédité - Il s'agit d'une maladie héréditaire progressive à transmission autosomique dominante avec une pénétrance variable entre les différents membres d'une même famille. La mutation a été localisée sur le gène BEST1 (VMD2) sur le chromosome 11.
Présentation - les symptômes peuvent apparaître au cours des deux premières décennies de la vie. L'acuité visuelle se détériore lorsque la lésion "jaune d'œuf" se rompt. Des changements se produisent dans les relevés de l'EOG chez les enfants avant qu'ils ne soient symptomatiques. La vision peut n'être que légèrement diminuée pendant l'enfance et l'adolescence lorsque la lésion du jaune d'œuf est présente. En général, la vision n'est pas affectée de manière significative avant la cinquième décennie.
Pronostic - la baisse de l'acuité visuelle peut être le reflet de la cicatrisation maculaire, mais d'autres complications peuvent s'y ajouter (par exemple, la formation d'un trou maculaire ou d'un décollement de la rétine). Certains patients deviennent légalement très malvoyants, mais la plupart d'entre eux conservent une capacité de lecture avec la vision d'un seul œil.
Dystrophie fovéomaculaire vitelliforme de l'adulte (dégénérescence vitelliforme de l'adulte)2 7
Description - cette maladie se caractérise par des lésions bilatérales et symétriques de la macula. Elles sont similaires à celles de la maladie de Best, mais elles sont plus petites, se manifestent à l'âge adulte et n'évoluent pas.
Hérédité - probablement autosomique dominante.
Présentation - 40-50 ans : vision floue ± déformation des images (métamorphopsie) qui peut être légère au point que cette affection est souvent découverte par hasard.
Pronostic - bon, sauf en cas de complications (telles que la néovascularisation de la choroïde sous-jacente).
Autres dystrophies maculaires héréditaires4
La dystrophie maculaire pseudo-inflammatoire de Sorsby, la dystrophie maculaire de Caroline du Nord et l'œdème maculaire cystoïde dominant sont de mauvais pronostic.
La dystrophie maculaire papillon est une affection relativement inoffensive (souvent découverte par hasard) qui se traduit par une légère altération de la vision centrale.
La dystrophie des formes se manifeste par une distorsion paracentrale et une perte d'acuité visuelle. Elle peut également être asymptomatique. De petites taches jaunes sont observées dans tout le fond d'œil, avec une atrophie maculaire associée.
Achromatopsie8
Description - cette maladie entraîne une perte totale de la fonction des cônes, tandis que la fonction des bâtonnets reste normale tout au long de la maladie. Sa prévalence est estimée à environ 1:30 000. Les cônes étant concentrés au niveau de la fovéa, la macula et la fovéa sont affectées de manière disproportionnée.
Hérédité - l'achromatopsie congénitale est transmise par un trait autosomique récessif.
Présentation - les patients se présentent dans la petite enfance avec un nystagmus, un comportement visuel anormal ou une photophobie. L'acuité visuelle est inférieure à 20/200. Le fond d'œil est sans particularité. Les champs visuels montrent un scotome central relatif. L'ERG est l'outil le plus utile pour évaluer la fonction. Il montre que la fonction des cônes est absente alors que celle des bâtonnets est normale. Des mutations dans plusieurs gènes ont été détectées et sont à l'origine de l'achromatopsie.
Pronostic - il n'y a pas de progression et aucun traitement autre que le soutien à la basse vision. La thérapie génique s'est avérée prometteuse : la restauration de la fonction des cônes a été obtenue dans des modèles animaux présentant des similitudes avec le phénotype humain, en utilisant une thérapie génique de remplacement à médiation virale avec différentes formes d'un promoteur de l'opsine du cône rouge.
Rétinoschisis lié à l'X2
Description et transmission - il s'agit d'une maladie récessive liée à l'X, causée par des mutations du gène RS1, qui code pour la protéine rétinoschisine. Il en résulte un rétinoschisis, c'est-à-dire une séparation des couches de la rétine, généralement dans la couche plexiforme externe. La partie de la rétine affectée présente une vision sous-optimale.
Présentation - elle touche presque exclusivement les jeunes hommes. La prévalence est estimée à environ 1:15 000-1:30 000. Le rétinoschisis périphérique est observé chez environ la moitié des patients. Le rétinoschisis fovéal est présent chez presque tous les patients et peut être visualisé par SD-OCT qui montre des espaces kystiques dans la rétine. La vision centrale peut être altérée, avec une acuité visuelle allant de 20/30 à moins de 20/200. La perte d'acuité est due à la formation de minuscules kystes entre les couches séparées de la rétine. Ces kystes se présentent souvent sous la forme d'une roue à rayons. La vision périphérique peut également être perdue si la couche interne de cellules nerveuses se sépare de la couche externe de cellules.
Pronostic - récemment, l'administration topique d'inhibiteurs de l'anhydrase carbonique, le dorzolamide et le brinzolamide, s'est révélée efficace pour réduire les kystes maculaires chez les patients atteints de rétinoschisis lié à l'X.
Drusen familial (dystrophie maculaire de Caroline du Nord)9
Description - cette affection (dont les sous-types sont connus sous le nom de choroïdite en nid d'abeille de Doyne ou de malattia leventinese) est considérée comme une forme précoce de dégénérescence maculaire liée à l'âge. Elle se caractérise par des taches jaune crème (drusen) bien définies sur la macula, qui peuvent éventuellement s'étendre largement sur le pôle postérieur de l'œil et autour du disque optique.
Hérédité - autosomique dominante avec pénétration complète mais expressivité variable.
Présentation - les drusen ne tendent à devenir un problème visuel que vers la cinquième décennie de la vie et les patients subissent alors un déclin visuel central.
Pronostic - il s'agit d'une maladie progressive, mais la vision périphérique est épargnée.
Dystrophie cristalline de Bietti10
Description - cette affection se caractérise par des dépôts cristallins dans la cornée périphérique et la rétine. Elle peut s'accompagner d'une atrophie rétinienne progressive.
Héritage - lié au chromosome X ou autosomique récessif.
Présentation - on observe une perte progressive de la vision au cours de la troisième décennie, en particulier de la vision périphérique et de la vision nocturne.
Pronostic - le taux de progression varie d'un individu à l'autre.
Dystrophies progressives des cônes11
Description - ce groupe de troubles rares englobe une gamme de problèmes allant du dysfonctionnement pur des cônes à ceux qui sont associés à des degrés divers à un dysfonctionnement des bâtonnets (généralement moins grave). De nombreux patients commencent par un problème de cône pur qui affecte progressivement les bâtonnets au fil du temps. Leur incidence estimée est de 1 sur 20 000 à 100 000.
Héritage - la plupart des cas sont sporadiques, mais on connaît aussi des cas d'hérédité autosomique dominante, autosomique récessive et liée à l'X.
Présentation - perte visuelle lente, progressive et bilatérale (vision nocturne meilleure que la vision diurne), photophobie, mauvaise vision des couleurs ± nystagmus. Il peut également y avoir des défauts du champ visuel associés.
Pronostic - à court terme, les personnes dont les tiges sont moins atteintes s'en sortent bien mais, à terme, les perspectives sont mauvaises.
Syndrome d'Alport12
Le syndrome d'Alport est une maladie génétique qui touche environ 1 enfant sur 5 000 et qui provoque une glomérulonéphrite, une insuffisance rénale terminale et une surdité de perception. Il peut également affecter les yeux.
Description - la maladie affecte la synthèse du collagène de type IV et entraîne des anomalies de la membrane basale qui se manifestent par une maladie rénale chronique et parfois par une surdité neurosensorielle. Diverses anomalies oculaires sont souvent observées, notamment un lenticône, un kératocône, une cataracte et des taches rétiniennes dans la macula et la périphérie moyenne. Ces anomalies menacent rarement la vision.
Hérédité - dominante liée au chromosome X.
Présentation - avec des problèmes rénaux et, bien que ce ne soit pas toujours le cas, une surdité de perception.
Pronostic - le pronostic visuel est bon ; l'acuité n'est normalement pas affectée. Le lenticône peut être traité par le remplacement du cristallin, comme pour la cataracte. Un kératocône léger peut être traité avec des lentilles de contact dures ou des lentilles piggy-back ; les cas graves peuvent nécessiter une greffe de cornée.
Rétine familiale mouchetée bénigne13 14
Dans cette maladie rare, les fundi sont massivement envahis par des lésions qui se présentent comme des taches discrètes, d'un blanc ou d'un jaune éclatant, situées bien en arrière des vaisseaux sanguins de la rétine. La macula est toujours épargnée. Les études à la fluorescéine révèlent une macula saine et des vaisseaux sanguins rétiniens et choroïdiens.
Description - lésions bénignes de forme irrégulière, épargnant la fovéa, qui recouvrent densément la rétine et s'étendent jusqu'à la périphérie. Elles peuvent être blanches, jaunes ou grises.
Héritage - autosomique récessif.
Présentation - asymptomatique, généralement découverte par hasard.
Pronostic - excellent, la vision n'est normalement pas affectée.
Amaurose congénitale de Leber (ACL)15 16 17
L'ACL est la plus grave des dystrophies rétiniennes. Les individus atteints se présentent généralement au cours de la première année de vie avec une déficience visuelle profonde, un nystagmus itinérant, une pathologie rétinienne variable et parfois d'autres pathologies systémiques. On sait aujourd'hui que la maladie est causée par au moins six gènes. Des mutations différentes dans plusieurs de ces gènes ont été observées à l'origine de la rétinite pigmentaire et d'autres dystrophies rétiniennes. Il est suggéré que le phénotype de l'ACL doit donc résulter de mutations qui ont les conséquences les plus graves.
La prévalence est estimée à 1 : 50 000-100 000. Il s'agit d'une cause héréditaire précoce de déficience visuelle sévère dans l'enfance, caractérisée par une dystrophie rétinienne sévère. Elle se manifeste généralement au cours de la première année de vie.
Description - la fonction visuelle est généralement médiocre et souvent accompagnée d'un nystagmus, de réponses pupillaires lentes ou absentes, d'une photophobie, d'une forte hypermétropie et d'un kératocône. L'acuité visuelle est rarement supérieure à 20/400.
Héritage - des variantes dans au moins six gènes ont été associées à l'ACL ou à la rétinite pigmentaire à début précoce, ce qui entraîne un héritage génétiquement hétérogène.
Présentation - les enfants sont gravement malvoyants dès la naissance ou au cours des premières années de leur vie. Le "signe oculo-digital de Franceschetti", qui consiste à toucher, presser et frotter les yeux, est un signe caractéristique. Le frottement constant des yeux entraîne une résorption de la graisse orbitaire et une endophtalmie subséquente (les yeux s'enfoncent dans les orbites). La rétine peut sembler normale au début, mais une rétinopathie pigmentaire similaire à la rétinite pigmentaire est fréquemment observée plus tard dans l'enfance. L'ERG est caractéristiquement non détectable ou sévèrement subnormal.
Pronostic - le traitement est un soutien. Les enfants bénéficient d'une correction de l'erreur de réfraction, de l'utilisation d'aides à la basse vision lorsque c'est possible et d'un soutien dans les possibilités d'éducation. Dans la mesure du possible, il convient de dissuader les enfants de se taper et d'appuyer sur leurs yeux de manière répétée. Chez ceux qui ont une vision résiduelle, il est nécessaire d'évaluer régulièrement l'amblyopie, le glaucome ou la cataracte. La thérapie génique pourrait être bénéfique à l'avenir : des essais de thérapie génique de remplacement ont permis de rendre la vue à des chiens atteints de cette maladie.18
Cécité nocturne stationnaire congénitale16 19
Il s'agit d'un groupe d'affections rares et non progressives de la rétine dans lesquelles une fonction anormale des bâtonnets entraîne une altération de la vision nocturne. La plupart des cas familiaux sont liés à l'X, bien qu'une dominance autosomique ait été décrite. Des symptômes oculaires sont associés, tels que la myopie, l'hypermétropie, le nystagmus et une acuité visuelle réduite.
Description - la prévalence de cette affection est inconnue mais très faible. Elle est présente dès la naissance.
Héritage - selon le sous-type, il peut s'agir d'une transmission autosomique dominante, autosomique récessive ou liée au chromosome X.
Présentation - mauvaise vision nocturne résultant d'un retard ou d'une incapacité à atteindre les seuils normaux des bâtonnets adaptés à l'obscurité. Les patients souffrent de cécité nocturne, d'acuité réduite, de myopie élevée, de nystagmus et de strabisme. Il existe deux types principaux : la forme complète et la forme incomplète. La forme complète provoque toujours une héméralopie, alors que la forme incomplète ne le fait pas toujours. Les deux types sont distingués par l'ERG.
Pronostic - il n'y a pas de progression.
Monochromatisme congénital20
Description - Il s'agit d'un terme générique utilisé pour décrire divers degrés de monochromatisme des bâtonnets ou de monochromatisme des cônes. Il peut être associé à des troubles de la fonction endocrinienne ou hypothalamique et à une surdité de perception.
Héritage - selon le sous-type, autosomique récessif ou lié au chromosome X.
Présentation - daltonisme : si la vision des couleurs est totalement absente, le monde est vu en nuances de gris. Il peut y avoir une certaine perception des couleurs dans le cas d'un monochromatisme en bâtonnets incomplet. Le monochromatisme des cônes est associé à une meilleure acuité visuelle (6/6 à 6/9) que le monochromatisme des bâtonnets (lorsque le monochromatisme est complet, l'acuité visuelle est de l'ordre de 6/60).
Pronostic - il n'y a pas de progression.
Le Dr Mary Lowth est l'auteur ou l'auteur original de cette brochure.
Autres lectures et références
- Institut royal national des aveugles (RNIB)
- Amaurose congénitale de LeberContacter une famille
- Ziccardi L, Cordeddu V, Gaddini L, et alLa thérapie génique dans les dystrophies rétiniennes. Int J Mol Sci. 2019 Nov 14;20(22):5722. doi : 10.3390/ijms20225722.
- Solebo AL, Teoh L, Rahi JÉpidémiologie de la cécité chez les enfants. Arch Dis Child. 2017 Sep;102(9):853-857. doi : 10.1136/archdischild-2016-310532. Epub 2017 May 2.
- Brito-Garcia N, Del Pino-Sedeno T, Trujillo-Martin MM, et alEffectiveness and safety of nutritional supplements in the treatment of hereditary retinal dystrophies : a systematic review (Efficacité et sécurité des compléments alimentaires dans le traitement des dystrophies rétiniennes héréditaires : une revue systématique). Eye (Lond). 2017 Feb;31(2):273-285. doi : 10.1038/eye.2016.286. Epub 2016 Dec 9.
- Kannabiran C, Mariappan ITherapeutic avenues for hereditary forms of retinal blindness (pistes thérapeutiques pour les formes héréditaires de cécité rétinienne). J Genet. 2018 Mar;97(1):341-352.
- Nentwich MM, Rudolph GOman J Ophthalmol, Hereditary retinal eye diseases in childhood and youth affecting the central retina, Oman J Ophthalmol, Oman J Ophthalmol. Oman J Ophthalmol. 2013 Sep;6(Suppl 1):S18-25. doi : 10.4103/0974-620X.122290.
- Moore T, Burton HGenetic Ophthalmology in Focus : A Needs Assessment & Review of Specialist Services for Genetic Eye Disorders, avril 2008.
- Rozet JM, Gerber S, Ducroq D, et alLes dystrophies maculaires héréditaires. J Fr Ophtalmol. 2005;28(1):113-24.
- Thumann GPerspectives pour la thérapie génique des dégénérescences rétiniennes. Curr Genomics. 2012 Aug;13(5):350-62. doi : 10.2174/138920212801619214.
- Shah M, Zaman M, Khan MT, et al.Réhabilitation visuelle des patients atteints de la maladie de Stargardt. J Coll Physicians Surg Pak. 2008 mai;18(5):294-8.
- Do P, Ferrucci SLa dystrophie vitelliforme fovéomaculaire de l'adulte. Optometry 2006 Apr;77(4):156-66.
- Komaromy AM, Alexander JJ, Rowlan JS, et alLa thérapie génique sauve la fonction des cônes dans l'achromatopsie congénitale. Hum Mol Genet. 2010 Jul 1;19(13):2581-93. doi : 10.1093/hmg/ddq136. Epub 2010 Apr 8.
- Zhu Z, Zou H, Li C, et alThe possible pathogenesis of macular caldera in patients with North Carolina macular dystrophy. BMC Ophthalmol. 2022 Nov 19;22(1):447. doi : 10.1186/s12886-022-02655-w.
- Vargas M, Mitchell A, Yang P, et alDystrophie cristalline de Bietti. GeneReviews®, avril 2012.
- Gill JS, Georgiou M, Kalitzeos A, et alProgressive cone and cone-rod dystrophies : clinical features, molecular genetics and prospects for therapy. Br J Ophthalmol. 2019 Jan 24;103(5):711-20. doi : 10.1136/bjophthalmol-2018-313278.
- Savige J, Lipska-Zietkiewicz BS, Watson E, et alGuidelines for Genetic Testing and Management of Alport Syndrome (Lignes directrices pour les tests génétiques et la prise en charge du syndrome d'Alport). Clin J Am Soc Nephrol. 2022 Jan;17(1):143-154. doi : 10.2215/CJN.04230321. Epub 2021 Dec 20.
- Bin NJ, Heng HM, Poh R, et al.Phospholipase A2 groupe v dans la rétine familiale bénigne en moucheture dans un ensemble de triplés. Retina. 2015 Jun;35(6):1266-72. doi : 10.1097/IAE.0000000000000446.
- Sabel Aish SF, Dajani BBenign familial fleck retina. Br J Ophthalmol. 1980 Sep;64(9):652-9.
- Francis PJGénétique des maladies rétiniennes héréditaires. J R Soc Med. 2006 Apr;99(4):189-91.
- Pusch CM, Zeitz C, Brandau O, et alThe complete form of X-linked congenital stationary night blindness is caused by mutations in a gene encoding a leucine-rich repeat protein. Nat Genet. 2000 Nov;26(3):324-7.
- Weleber RG, Francis PJ, Trzupek KM, et al.Amaurose congénitale de Leber
- Drack AV, Johnston R, Stone EMQuels sont les patients atteints d'amaurose congénitale de Leber qui peuvent faire l'objet d'essais de thérapie génique ? J AAPOS. 2009 Oct;13(5):463-5.
- Abramowicz MJ, Ribai P, Cordonnier MCongenital stationary night blindness : report of an autosomal recessive family and linkage analysis. Am J Med Genet A. 2005 Jan 1;132A(1):76-9.
- Jan JE, Tze WJ, Johnston AC, et alFamilial congenital monochromatism, cataracts, and sensorineural deafness. Am J Dis Child. 1976 Dec;130(12):1349-50.
Poursuivre la lecture ci-dessous
Historique de l'article
Les informations contenues dans cette page sont rédigées et évaluées par des cliniciens qualifiés.
Prochaine révision prévue : 19 juillet 2028
21 juillet 2023 | Dernière version

Demandez, partagez, connectez-vous.
Parcourez les discussions, posez des questions et partagez vos expériences sur des centaines de sujets liés à la santé.

Vous ne vous sentez pas bien ?
Évaluez gratuitement vos symptômes en ligne